Neurotransmissores excretados na urina como biomarcadores da atividade do sistema nervoso: Validade e aplicabilidade clínica
David T. Marc, Joseph W. Ailts, Danielle C. Ailts Campeau, Michael J. Bull, Kelly L. OlsonNeuroScience, Inc. 373 280thStreet, Osceola, WI 54020, United States
Resumo
As estratégias para gerenciar o sistema nervoso são numerosas, enquanto os métodos de avaliação do sistema nervoso são limitados. Dada a importância fisiológica dos neurotransmissores como moléculas sinalizadoras no sistema nervoso, a medição dos neurotransmissores tem um potencial significativo como ferramenta clínica. De todos os fluidos biológicos que podem ser utilizados, o teste de neurotransmissores urinários, devido à sua estabilidade, sensibilidade e não invasividade, é o método desejado para analisar a função do sistema nervoso. O uso crescente desta tecnologia em ambiente clínico exige uma revisão de sua viabilidade, utilidade e valor clínico. Revisamos o corpo atual da literatura referente ao mecanismo de transporte de neurotransmissores através da barreira hematoencefálica, bem como à filtração e excreção de neurotransmissores pelos rins. Além disso, esta revisão resume o uso histórico da avaliação dos neurotransmissores urinários para diagnosticar o feocromocitoma. As primeiras pesquisas também correlacionaram a avaliação urinária de neurotransmissores a vários sintomas clínicos e tratamentos dos quais apresentamos pesquisas apenas para depressão, TDAH e inflamação devido à abundante quantidade de pesquisas nessas áreas. Finalmente, revisamos as limitações e desafios dos testes de neurotransmissores urinários. Em conjunto, as evidências sugerem que os neurotransmissores excretados na urina podem ter um lugar na prática clínica como biomarcadores da função do sistema nervoso para avaliar eficazmente os distúrbios e monitorizar a eficácia do tratamento.
1. Introdução
Os neurotransmissores são os principais mensageiros químicos liberados pelos neurônios e retransmitem, amplificam e modulam sinais para outras células. Devido à contribuição significativa dos neurotransmissores não apenas para o funcionamento neurológico, mas também para as ações endocrinológicas e imunológicas, médicos e pesquisadores estão interessados na função e medição dos neurotransmissores, pois eles têm o potencial de servir como biomarcadores clinicamente relevantes para estados patológicos específicos ou para monitorar eficácia do tratamento (Cook, 2008).
A consideração inicial sobre a identificação de mensageiros químicos começou em 1902, quando Ernest Starling e William Bayliss introduziram a existência de um sistema de comunicação interna com a descoberta do primeiro hormônio, a secretina (Zarate e Saucedo, 2005). Posteriormente, os cientistas identificaram vários outros mensageiros químicos no corpo, como epinefrina e norepinefrina (Henderson, 2005). A medição de mensageiros químicos foi rapidamente adotada como meio de avaliar funções de órgãos ou tecidos e tornou-se a base para diagnósticos ou indicadores funcionais na prática clínica. Apesar da ausência histórica de biomarcadores relevantes no domínio da psiquiatria clínica, este formato expandiu-se (Cook, 2008, Wong et al., 2002) e os neurotransmissores servem agora como alvo primário para o desenvolvimento de biomarcadores preditivos ou correlativos da função do sistema nervoso. (Wong et al., 2002). Portanto, a revisão a seguir fornece um resumo das evidências científicas sobre a validade, viabilidade e utilidade clínica dos testes de neurotransmissores urinários.
1.1 História da medição de neurotransmissores urinários
Os neurotransmissores estão presentes em todo o corpo e são representados por pesquisas que demonstram medições em vários fluidos biológicos, incluindo soro, plasma, plaquetas, líquido cefalorraquidiano (LCR), saliva e urina (Roy et al., 1988, Okumura et al., 1997) . A urina, devido ao seu método de coleta não invasivo e por ser o principal método de eliminação de neurotransmissores, tem sido o fluido corporal preferido para medições de neurotransmissores (Lepschy et al., 2008). Por quase 60 anos, estudos utilizaram medições urinárias de neurotransmissores e metabólitos de neurotransmissores. Desde a década de 1950, o aumento da excreção urinária de dopamina (DA), norepinefrina (NE) e epinefrina (E), as três catecolaminas que ocorrem naturalmente, tem sido usado para diagnosticar feocromocitoma (Duncan et al., 1988, Engel e von Euler, 1950). , Moyer et al., 1979, Rosano et al., 1991). O feocromocitoma é um tumor raro da medula da glândula adrenal, resultando na superprodução de catecolaminas acompanhada de hipertensão (Westphal, 2005). De acordo com isso, estudos realizados na Clínica Mayo em Rochester, MN, sugeriram que a metanefrina urinária de 24 horas, um metabólito E e as medições de catecolaminas são os testes de escolha para o diagnóstico de feocromocitoma em um ambiente clínico para evitar resultados falso-positivos excessivos numa determinada população de baixo risco (Kudva et al., 2003).
Desde o início dos testes de neurotransmissores urinários, os métodos para medir as catecolaminas foram aprimorados tanto na sensibilidade quanto na especificidade. A pesquisa inicial sobre catecolaminas foi dificultada pela limitação de ensaios colorimétricos e bioensaios que careciam de sensibilidade e especificidade adequadas (Kagedal e Goldstein, 1988). A tecnologia progrediu com o desenvolvimento e utilização de métodos fluorométricos. Mais recentemente, a metodologia de cromatografia líquida de alta eficiência (HPLC) melhorou bastante a especificidade e a sensibilidade dessas medições e permitiu aplicações clínicas em maior escala (Kagedal e Goldstein, 1988, Westermann et al., 2002, Panholzer et al., 1999). As tecnologias de ensaio imunoabsorvente enzimático (ELISA) e radioimunoensaio (RIA) oferecem as maiores alternativas metodológicas, permitindo maior rendimento, maior sensibilidade e especificidade e custo reduzido (Westermann et al., 2002, Huisman et al., 2010, Francisco et al., 2010). Portanto, o avanço na metodologia aumentou não apenas o potencial de pesquisa, mas também a viabilidade de introdução da medição de neurotransmissores em um ambiente clínico devido ao alto rendimento e aos baixos custos.
1.2 Transporte de neurotransmissores e barreira hematoencefálica
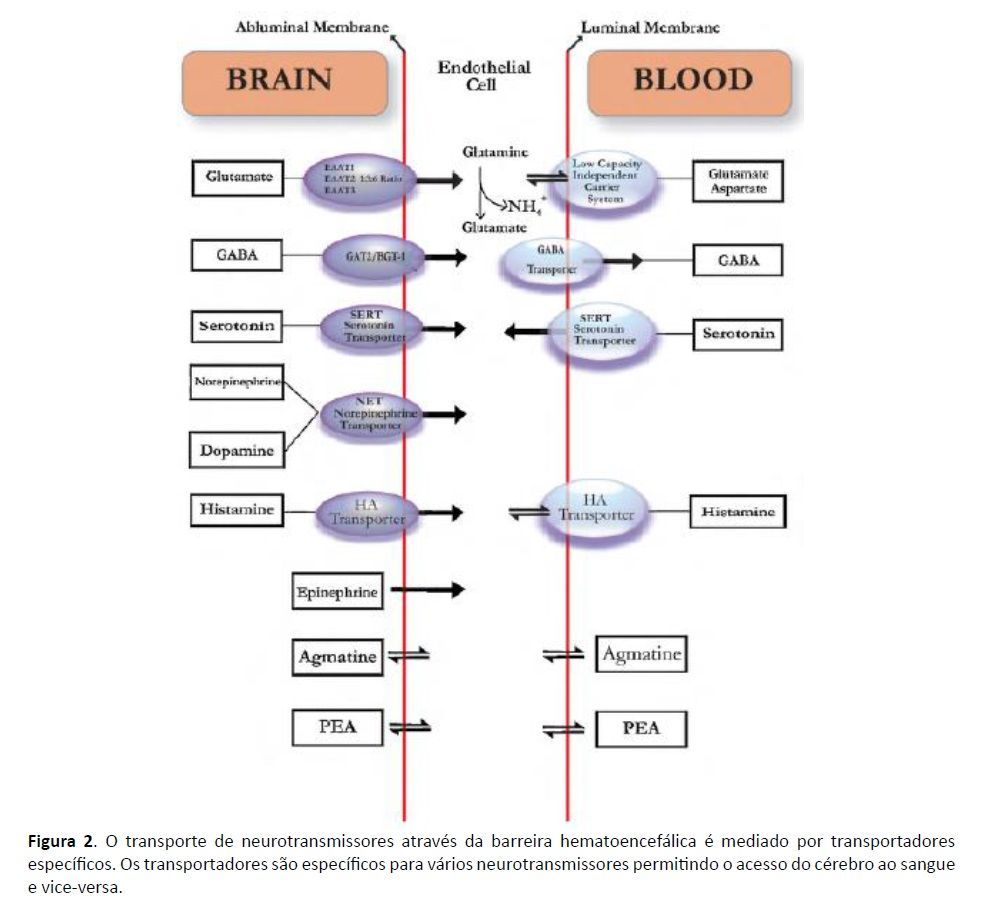
Os neurotransmissores desempenham funções biológicas específicas em todo o corpo; no entanto, o importante papel dos neurotransmissores na regulação da função neurológica no cérebro levou a pesquisas significativas com foco no movimento dos neurotransmissores de e para o cérebro. A passagem de moléculas para dentro e para fora do sistema nervoso central (SNC) é altamente regulada pela barreira hematoencefálica (BHE) (Ballabh et al., 2004, Rubin e Staddon, 1999). Três elementos celulares da microvasculatura cerebral compreendem a BBB: células endoteliais, pés terminais de astrócitos e pericitos (PCs) (Ballabh et al., 2004). Localizada dentro dos capilares que levam sangue ao cérebro, a BBB é uma única camada de células endoteliais especializadas, conhecidas como células endoteliais capilares cerebrais (BCECs) (Rubin e Staddon, 1999). Os BCECs são conectados por junções estreitas altamente resistentes (Rubin e Staddon, 1999) e são polarizados em domínios de membrana plasmática luminal (voltados para o sangue) e abluminais (voltados para o cérebro) (Hawkins et al., 2006; ver Fig. 1). A permeabilidade seletiva das BCECs desempenha um papel protetor, limitando a passagem de moléculas para o SNC, evitando assim que muitas moléculas perturbadoras ou prejudiciais entrem no cérebro (Pardridge, 1999). Algumas moléculas, no entanto, são transportadas para o SNC, como os aminoácidos obtidos na dieta, que são então sintetizados em neurotransmissores nos neurônios cerebrais (Fernstrom e Fernstrom, 2007, Hawkins et al., 2006, Wurtman, 1987, Wurtman, 1988 ). Outras moléculas têm a capacidade de serem transportadas do SNC para a periferia. É um equívoco comum que moléculas, como neurotransmissores, não possam ser transportadas do SNC para a periferia (Ohtsuki, 2004). Pelo contrário, um grande conjunto de pesquisas demonstrou que as BCECs possuem transportadores específicos que regulam a passagem de neurotransmissores para fora do SNC (Hawkins et al., 2006, Ohtsuki, 2004, Rubin e Staddon, 1999, Tamai e Tsuji, 2000; ver Tabela 1).
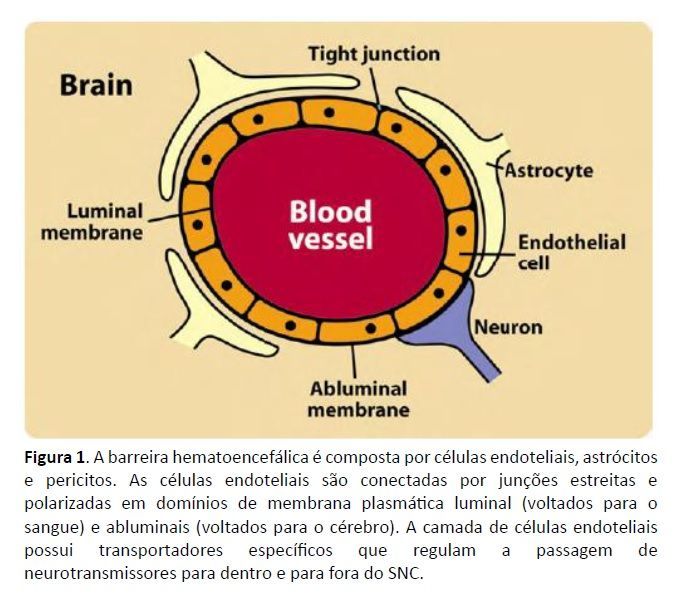
Os transportadores da BBB que transportam neurotransmissores e seus metabólitos para fora do SNC estão representados na Fig. 2. Estudos documentaram a presença de vários transportadores importantes de neurotransmissores na BBB, como o transportador de serotonina (SERT) (Nakatani et al., 2008), transportador de noradrenalina (NET) (Wakayama et al., 2002), transportador GABA (GAT) (Takanaga et al., 2001) e transportador de aminoácidos excitatórios (EAAT) (Hawkins et al., 2006). Outros estudos demonstraram a capacidade dos neurotransmissores de atravessar as membranas endoteliais cerebrais, apoiando ainda mais o efluxo intacto de neurotransmissores do SNC (Huszti et al., 1995, Szabo et al., 2001; ver Tabela 1). Conforme mostrado na Tabela 1, os transportadores localizados nas membranas abluminais e/ou luminais permitem o transporte facilitado de neurotransmissores específicos do cérebro para o sangue. Em particular, os transportadores identificados na membrana abluminal transportam GABA, dopamina, noradrenalina, serotonina, glutamato, ácido aspártico e histamina do cérebro para os BCECs. Da mesma forma, os transportadores identificados nas membranas luminais permitem o transporte de GABA, glutamato, ácido aspártico e histamina dos BCECs para o sangue com transporte bidirecional de glutamato, ácido aspártico e histamina. A serotonina transportada através do transportador de serotonina (SERT) é retirada do sangue para os BCECs. Por último, a agmatina e a PEA podem atravessar livremente a BBB devido à sua lipofilicidade (ver Tabela 1; ver Fig. 2). Com base nesta informação, as evidências apoiam um mecanismo de transporte hematoencefálico que é específico do substrato e pode ser unidirecional ou bidirecional.
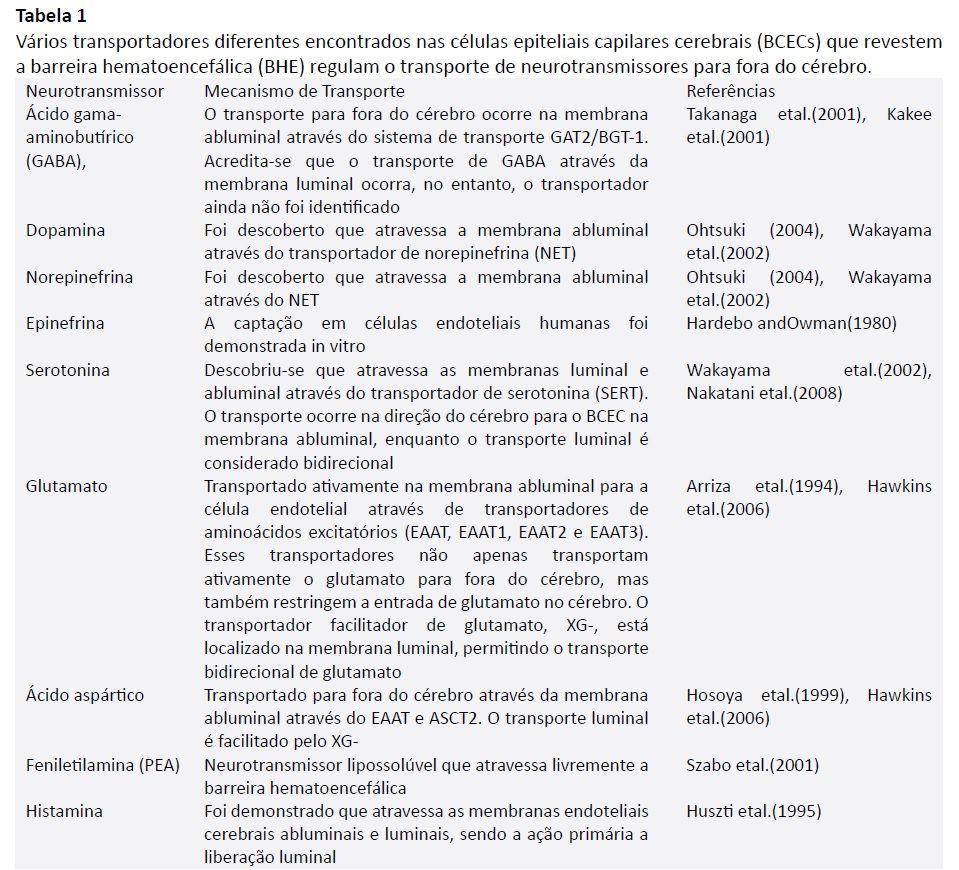
Os BCECs são polarizados em membranas luminais e abluminais e os transportadores podem ser encontrados em qualquer uma dessas membranas.
1.3 Transporte de neurotransmissores e os rins
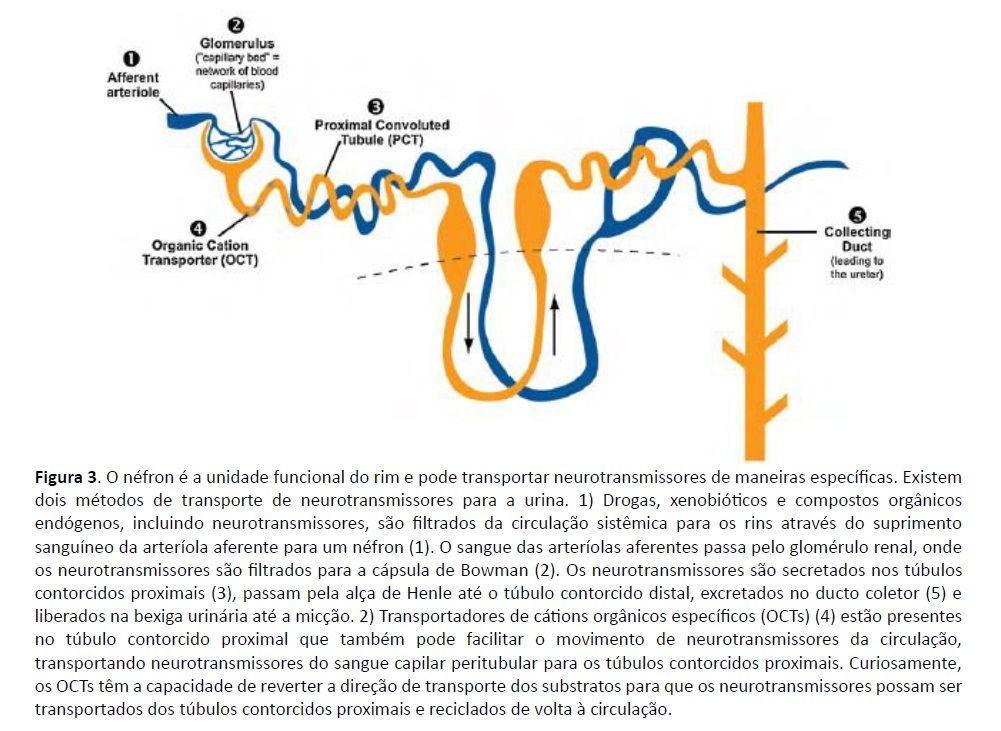
Esta revisão apresenta informações que elucidam o papel dos mecanismos de transporte de neurotransmissores dos rins, filtração de néfrons, transporte ativo, síntese intra-renal e inervação nervosa como contribuintes para o conjunto total de neurotransmissores urinários. Os neurotransmissores circulantes são filtrados do sangue pelos néfrons, as unidades funcionais dos rins, e posteriormente excretados na urina (Moleman et al., 1992). Estudos identificaram a presença de moléculas de transporte de neurotransmissores em néfrons que movem neurotransmissores do espaço extracelular para abolir suas ações biológicas e excretá-los ativamente na urina (Amara e Kuhar, 1993, Grundemann et al., 1998, Grundemann et al., 1997 , Chen et al., 2004, Hayer-Zillgen et al., 2002, Kopp et al., 1983). Entre estes, os transportadores de cátions orgânicos (OCTs) são importantes facilitadores da captação eletrogênica de pequenos cátions, como drogas, xenobióticos e compostos endógenos (colina, DA, NE, E, serotonina, histamina e tiramina) da circulação, e são presente nos túbulos contorcidos proximais dos néfrons (Grundemann et al., 1998, Karbach et al., 2000). Uma propriedade notável dos OCTs é a reversibilidade da direção de transporte dependente da concentração, facilitando assim o transporte bidirecional de cátions orgânicos (Busch et al., 1998, Gorboulev et al., 1997, Kekuda et al., 1998, Koepsell et al., 1999).
Existem três subtipos de OCT, incluindo OCT3 (Kekuda et al., 1998), OCT2 (Grundemann et al., 1998) e OCT1 (Busch et al., 1996, Kekuda et al., 1998). O subtipo OCT3 é expresso principalmente no tecido renal e cerebral (Wu et al., 2000). Especificamente, o OCT3 está localizado no hipocampo, cerebelo e córtex cerebral e medeia a captação de DA em células de mamíferos (Wu et al., 1998). O subtipo OCT2 foi caracterizado em células renais embrionárias humanas (Grundemann et al., 1997, Kekuda et al., 1998) e está envolvido no transporte transmembrana de colina, DA, NE, E, serotonina, histamina e tiramina (Grundemann et al., al., 1998, Kekuda et al., 1998). Experimentos imuno-histoquímicos sugerem que o OCT2 humano está localizado nos rins, na membrana basolateral dos túbulos contorcidos proximais (Karbach et al., 2000). Além disso, o OCT2 é encontrado em regiões específicas do cérebro que são ricas em DA, incluindo o núcleo accumbens, corpo estriado e substância negra (Grundemann et al., 1997). Semelhante ao OCT2, o OCT1 é expresso nos rins e também no fígado, onde pode transportar tiramina, epinefrina, dopamina, serotonina e norepinefrina (Breidert et al., 1998). OCT1 fornece transporte bidirecional, dependente do pH, para vários cátions orgânicos para facilitar a eliminação de tais produtos bioquímicos (Yabuuchi et al., 1999). Recentemente, foi identificado um novo transportador, denominado transportador de monoaminas de membrana plasmática (PMAT ou ENT4). O PMAT é expresso no cérebro, músculo esquelético, fígado, rim e coração (Engel e Wang, 2005). O PMAT é um transportador independente de Na+ e sensível ao potencial de membrana, que compartilha semelhanças funcionais com os OCTs e também transporta os neurotransmissores monoamina do sangue para os rins (Grundemann et al., 1997, Engel e Wang, 2005). Em conjunto, o transporte de neurotransmissores específicos mediado por OCT e PMAT da circulação para os rins fornece um mecanismo importante para regular os níveis de neurotransmissores no sangue e a excreção na urina.
Os neurotransmissores são retirados da circulação sistêmica, transportados para os rins e depois excretados na urina por transporte ativo via OCT, bem como por filtração glomerular. Esses dois mecanismos de transporte de neurotransmissores nos rins foram bem estabelecidos: (1) os neurotransmissores monoamina são excretados por ultrafiltração do sangue arterial para os glomérulos, secretados nos túbulos proximais, posteriormente distribuídos através do ducto coletor até a bexiga urinária e excretados no urina (Graefe et al., 1997), (2) nas membranas luminal e basolateral dos túbulos proximais renais, o OCT2 é responsável pela reabsorção e secreção de compostos endógenos, incluindo neurotransmissores monoamina (Koepsell et al., 1998) (Fig. 3.). Isto é conseguido pela captação eletrogênica de neurotransmissores monoamina na membrana basolateral via OCTs e liberação de cátions na membrana luminal das células epiteliais tubulares proximais mediada por um antiportador de prótons eletroneutro (Koepsell et al., 1998). A pesquisa demonstrou que a colina e outros cátions podem ser reabsorvidos do túbulo proximal através de OCTs e devolvidos à circulação quando as concentrações são baixas no plasma (Acara e Rennick, 1973). Assim, os cátions localizados no túbulo proximal podem ser transportados para o plasma para compensar os baixos níveis de cátions circulantes, proporcionando assim um mecanismo regulador para manter níveis suficientes de cátions em circulação.
Foi demonstrado que o disprocínio24, um potente inibidor do transporte extraneuronal de monoaminas, bloqueia os OCTs, reduzindo assim a depuração global das catecolaminas do plasma (Wu et al., 1998). Coletas de urina obtidas de animais anestesiados tratados com Disprocynium24 exibiram reduções acentuadas em DA, NE e E urinários (Acara e Rennick, 1973, Graefe et al., 1997) com concentrações plasmáticas aumentadas de NE, E, normetanefrina e metanefrina (Eisenhofer et al., 1996). Esta observação demonstrou que o Disprocynium24 diminuiu a depuração de catecolaminas do plasma (Graefe et al., 1997). Com base nesta pesquisa, é evidente que o nível de catecolaminas na urina depende da concentração plasmática e da captação dos OCTs (Eisenhofer et al., 1996, Graefe et al., 1997). A inibição da OCT com Disprocynium24 pode levar à diminuição da excreção urinária de catecolaminas com subsequentes aumentos nos níveis plasmáticos de catecolaminas (Graefe et al., 1997). Portanto, a excreção urinária de neurotransmissores mediada pela OCT depende das concentrações circulantes de neurotransmissores (Chekhonin et al., 2000, Davis et al., 1978, Lynn-Bullock et al., 2004, Seegal et al., 1986, Westermann et al., 1986, Westermann et al. , 2002).
Embora os neurotransmissores captados através de OCTs contribuam largamente para o conjunto global de neurotransmissores urinários, outros mecanismos também oferecem contribuições. Estudos sugeriram que os rins humanos contêm enzimas necessárias para sintetizar e metabolizar neurotransmissores monoaminas. Este processo, semelhante à síntese de neurotransmissores no cérebro, parece depender da disponibilidade de precursores e estudos relataram mudanças paralelas durante o tratamento com pró-fármacos de serotonina e dopamina (Wa et al., 1995, Dantonello et al., 1998). Os rins também recebem informações neurais dos nervos simpáticos, que podem liberar norepinefrina e dopamina nos rins, adicionando assim um processo adicional que potencialmente influencia as concentrações de neurotransmissores urinários (Wa et al., 1995, Noshiro et al., 1991). O grau em que a síntese de neurotransmissores renais pode influenciar os níveis de neurotransmissores urinários deve ser considerado como um fator potencial que pode contribuir para o conjunto total de neurotransmissores urinários. Um estudo que examinou a excreção renal de catecolaminas demonstrou como a estimulação do nervo renal levou a um ligeiro aumento na produção urinária de catecolaminas (Kopp et al., 1983). Contudo, com base nos dados recolhidos, os investigadores concluíram que a excreção urinária de catecolaminas era um mau indicador da libertação de catecolaminas pelo nervo renal (Kopp et al., 1983).
Informações conclusivas que avaliaram a contribuição do débito central e periférico para a excreção urinária de neurotransmissores são escassas. Uma tentativa de Graefe et al. (1997) quantificaram o nível de excreção de catecolaminas na urina derivada do plasma medindo a excreção de níveis de catecolaminas radiomarcadas na urina dividida pelo nível de catecolaminas radiomarcadas no plasma. Eles concluíram que 100% do E urinário, 68% do NE e 2,3% do DA provinham da circulação (Graefe et al., 1997). O restante do NE é proveniente da liberação do nervo renal, enquanto o restante do DA é de múltiplas fontes, incluindo: síntese renal de DA, liberação de DA dos nervos renais e DA formado pela desconjugação de conjugados DA circulantes (Graefe et al., 1997). Embora não confirmados, estes resultados demonstram como a contribuição renal para a excreção global de neurotransmissores pode variar para cada neurotransmissor e destaca o valor da urina como um meio de avaliar distúrbios na função dos neurotransmissores em todo o sistema.
1.4 Neurotransmissores urinários e associações do SNC
Embora não seja totalmente compreendido se existe uma associação direta entre os níveis de neurotransmissores no SNC e os níveis de neurotransmissores excretados na urina, alguns estudos sugeriram uma ligação (Matsuda et al., 1991, Chekhonin et al., 2000, Lynn-Bullock e outros, 2004). As primeiras pesquisas de Maas e Landis (1965) descreveram uma rota potencial de transporte de NE do cérebro para a urina. Eles investigaram a cinética do metabolismo do NE no cérebro de cães injetando H3 NE na cisterna magna, que é uma abertura no espaço subaracnóideo entre as camadas aracnóide e pia-máter das meninges que circundam o cérebro. Depois de injetar H3 NE na cisterna magna, os pesquisadores observaram uma quantidade significativa de H3 NE no sangue com rápida eliminação do sangue na urina (Maas e Landis, 1965). Com base nestas observações, os autores propuseram que a H3 NE urinária e os metabolitos da H3 NE provinham, pelo menos em parte, do SNC (Maas e Landis, 1965).
Outros estudos em animais realizados em ratos examinaram os efeitos da ingestão oral do substrato da serotonina, 5-hidroxitriptofano (5-HTP), em regiões específicas do cérebro (Lynn-Bullock et al., 2004). A serotonina é um neurotransmissor monoamina e está implicada em muitas funções fisiológicas e comportamentais, incluindo: afeto, agressão, apetite, cognição, êmese, função endócrina, função gastrointestinal, função motora, neurotrofismo, percepção, função sensorial, sexo, sono e função vascular (Bloom e Kupfer, 1995, Lynn-Bullock et al., 2004). Os níveis de serotonina foram medidos usando imunorreatividade do tecido cerebral e urinálise e observaram imunorreatividade máxima da serotonina no núcleo serotoninérgico dorsal da rafe dentro de 2 horas após a administração de 5-HTP. A análise urinária de serotonina, 5-HTP e ácido 5-hidroxiindolacético (5-HIAA), um metabólito da serotonina, apresentou alterações paralelas na imunorreatividade ao núcleo dorsal da rafe, demonstrando uma correlação positiva entre a atividade serotonérgica do SNC e os níveis de serotonina urinária (Lynn- Bullock et al., 2004) e possíveis paralelos nos mecanismos que regulam os níveis de neurotransmissores urinários e do SNC.
Outro estudo em ratos investigou o efeito do hemiparkinsonismo induzido por 6-hidroxidopamina (6-OHDA) no metabolismo das catecolaminas, bem como a relação entre o conteúdo cerebral de catecolaminas e a excreção urinária de catecolaminas (Chekhonin et al., 2000). Chekhonin et al. (2000) induziram hemiparkinsonismo, identificado quando os sintomas de Parkinson se apresentam unilateralmente, após a injeção do composto neurotóxico 6-OHDA no corpo estriado do rato. Foi relatada uma correlação positiva entre as concentrações urinárias e estriatais de DA. Os investigadores concluíram que a medição das catecolaminas urinárias e dos seus metabolitos pode ser um biomarcador para avaliar o estado do sistema nigrostriatal dopaminérgico do cérebro no parkinsonismo experimental (Chekhonin et al., 2000).
Uma limitação consistente ao longo destes estudos é a falta de dados humanos. Na ausência de estudos humanos comparando a produção de neurotransmissores urinários com a atividade do sistema nervoso central, os pesquisadores tentaram correlacionar os níveis de neurotransmissores na urina e no líquido cefalorraquidiano (LCR) em humanos (Castellanos et al., 1994, Swann et al., 1987, Koslow et al., 1994, Swann et al., 1987, Koslow et al., 1994, Swann et al., 1987, Koslow et al. al., 1986). Embora uma grande quantidade de pesquisas tenha examinado as correlações entre o LCR e várias condições, uma revisão da literatura não revelou nenhum estudo que sugerisse que as medições do LCR fossem biomarcadores viáveis para qualquer condição psicológica. Nem há evidências conclusivas que sugiram que o LCR possa ser um correlato clínico superior à urina (Roy e Pollack, 1994). Roy e Pollack (1994) descobriram que as medidas urinárias do metabolismo DA tinham uma associação mais forte com tentativas de suicídio na depressão do que o LCR. Além disso, uma consideração primária em relação à utilização do LCR em ambiente clínico é o risco inerente associado ao procedimento de coleta invasiva. Os estressores mentais, físicos e emocionais que acompanham a coleta de LCR podem ativar vias de estresse neurológico e, assim, alterar as respostas dos neurotransmissores (Nigrovic et al., 2007). Portanto, técnicas de coleta adequadas são cruciais para a coleta de LCR para evitar que uma resposta ao estresse possa distorcer os resultados obtidos (Manyam e Hare, 1983, Wood, 1980).
No geral, a pesquisa acima sugere uma relação entre as medições dos neurotransmissores urinários e os níveis do SNC. Atualmente, a quantidade exata de neurotransmissores do SNC que contribuem para o conjunto urinário geral é desconhecida. Devido à presença da barreira hemato-SNC que limita o transporte de neurotransmissores da periferia para o SNC, muitos acreditam que marcadores periféricos, como neurotransmissores plasmáticos ou urinários, são maus indicadores da função do SNC (Ohtsuki, 2004). Outros sugeriram que a associação entre neurotransmissores na periferia e neurotransmissores no SNC pode ser compreendida através do crosstalk neuronal entre o cérebro e o resto do corpo (Lechin et al., 1996). Lechin et al. (1996) forneceram uma explicação sobre a relação entre os neurotransmissores do SNC e do SNP para descrever como a medição da atividade periférica pode fornecer informações clínicas sobre os perfis do SNC e auxiliar na seleção do tratamento. Eles propõem que existem muitas ligações que conectam o cérebro e o corpo, incluindo neurotransmissores liberados por neurônios periféricos e células glandulares (adrenais, células enterocromafins, mastócitos), que juntos são liberados na corrente sanguínea. Eles prosseguem dizendo que, embora os neurotransmissores não possam entrar facilmente no cérebro, a pesquisa básica e clínica estabeleceu a relação entre as atividades dos neurotransmissores do SNC e do SNP. Portanto, Lechin et al. (1996) sugerem que é possível obter algumas informações sobre a função do SNC através da medição dos neurotransmissores circulantes.
Lechin e outros ilustraram claramente a relação e a interferência entre o SNC e o SNP (Gallowitsch-Puerta e Pavlov, 2007, Lechin e van der Dijs, 2006, Mayer et al., 2006). Pesquisas futuras, no entanto, devem expandir nossa compreensão dos circuitos específicos do SNC que contribuem para alterações específicas dos neurotransmissores periféricos.
Embora uma associação direta entre neurotransmissores no SNC e aqueles excretados na urina ainda não esteja definida, o valor dos neurotransmissores excretados na urina como biomarcadores do sistema nervoso pode ser melhor avaliado examinando-se as correlações com várias condições clínicas. Curiosamente, a maioria das pesquisas que examinaram a utilidade clínica dos testes de neurotransmissores urinários concentraram-se apenas em alguns distúrbios: depressão, transtorno de déficit de atenção e hiperatividade (TDAH) e inflamação têm sido o foco principal da investigação para tentar delinear a utilidade clínica da avaliação dos neurotransmissores urinários.
1.5 Neurotransmissores urinários e sintomas depressivos
Nos anos desde que von Euler publicou dados sobre a excreção de neurotransmissores urinários e seus metabólitos (von Euler e Luft, 1951, von Euler e Hellner, 1951), numerosos estudos testaram os níveis de neurotransmissores urinários em vários distúrbios psicológicos (Manyam e Hare, 1983, von Euler et al., 1955, von Euler e Luft, 1951, Wood, 1980). Especificamente, estudos sugeriram que avaliações de neurotransmissores urinários podem ser um meio viável para descrever um estado de doença e monitorar intervenções terapêuticas (Baker et al., 1991, Delahanty et al., 2005, Hughes et al., 2004, Mooney et al., 2008 , Otte et al., 2005, Kotzailias et al., 2004).
Em consonância com esses estudos, a pesquisa descreveu a utilidade da análise dos neurotransmissores urinários na depressão bipolar (Koslow et al., 1983) e nos subtipos de depressão unipolar (Schildkraut et al., 1978). Especificamente, os pacientes que preencheram os critérios para um episódio depressivo maior apresentaram níveis globais mais elevados de NE urinária do que os controles (Roy et al., 1986a, Roy et al., 1986b). Da mesma forma, Koslow et al. (1983) descobriram que, em comparação com os controles, os pacientes deprimidos apresentavam níveis significativamente mais elevados de NE urinário junto com E e seus metabólitos. Os pesquisadores concluíram que a renovação total das catecolaminas corporais (medição das catecolaminas urinárias e seus metabólitos) pode fornecer informações mais úteis do que apenas medidas de metabólitos (Koslow et al., 1983). Além disso, descobriu-se que níveis mais elevados de NE urinário distinguem pacientes deprimidos unipolares de bipolares (Koslow et al., 1983). Desde então, outros estudos confirmaram a relação positiva com NE urinária e depressão (Hughes et al., 2004, Roy et al., 1986a, Roy et al., 1986b, Grossman e Potter, 1999), enquanto outros estudos revelaram uma elevação geral nas catecolaminas urinárias em pacientes deprimidos unipolares em comparação com pacientes bipolares (Joyce et al., 1995, Maas et al., 1987, Schatzberg, 1998, Schildkraut et al., 1978). Mais recentemente, Hughes et al. (2004) observaram que níveis mais elevados de sintomas depressivos, avaliados pelo Inventário de Depressão de Beck, estavam associados ao aumento da excreção de NE na urina. Os sintomas de ansiedade, avaliados pela porção de ansiedade-estado do Inventário de Ansiedade Traço-Estado de Spielberger, também foram associados ao aumento da excreção de NE na urina (Hughes et al., 2004). Os investigadores concluíram que, na depressão e na ansiedade, o aumento da atividade do sistema nervoso simpático (SNS) contribuiu para um aumento da taxa de mortalidade nestes pacientes (Hughes et al., 2004, Otte et al., 2005).
Embora a avaliação dos neurotransmissores urinários tenha identificado diferenças bioquímicas, ainda não foi aceita como diagnóstico de depressão ou de qualquer doença ou condição específica. No futuro, é possível que os efeitos acumulativos da combinação de informações, como os atuais protocolos de diagnóstico juntamente com a avaliação dos neurotransmissores, permitam que os neurotransmissores urinários desempenhem um papel diagnóstico. A partir de agora, o uso de testes urinários de neurotransmissores como biomarcador pode ser mais bem aplicado para orientar decisões terapêuticas e ajudar os profissionais em ambientes clínicos a prever eficazmente as respostas ao tratamento (Holsboer, 2008). Muitas doenças são tratadas com intervenções nutricionais, farmacêuticas e elétricas que afetam os neurotransmissores. Infelizmente, devido à comorbidade significativa de doenças relacionadas aos neurotransmissores e à natureza espectral dos desequilíbrios subjacentes dos neurotransmissores que as desencadeiam, o sucesso do tratamento é muitas vezes difícil de alcançar ou identificar (Benazzi, 2006, Nemeroff, 2007). Atualmente, estão sendo procuradas ferramentas de triagem para orientar a seleção de intervenções específicas e melhorar as taxas de resposta dos pacientes (Le-Niculescu et al., 2008, Schwarz e Bahn, 2008). Portanto, as medições dos neurotransmissores urinários podem ser uma ferramenta valiosa na avaliação e subsequente gestão de um grande número de condições clínicas.
Como observado em pacientes com depressão, estudos demonstraram que a baixa excreção urinária de 3-metoxi-4-hidroxifenilglicol (MHPG), um metabólito de NE, prediz uma resposta positiva a medicamentos seletivos para NE, como imipramina, nortriptilina, desipramina ou maprotilina (Mooney et al., 1991, Mooney et al., 2008, Schildkraut et al., 1992). Indivíduos com MHPG urinário elevado previram uma resposta positiva ao benzodiazepínico alprazolam (Mooney et al., 1985, Mooney et al., 1988) e uma resposta fraca à imipramina, nortriptilina, desipramina e maprotilina (Mooney et al., 1991, Mooney et al., 2008, Schildkraut et al., 1992). Estes estudos, portanto, ilustram a importância das medições dos neurotransmissores urinários na orientação da seleção do tratamento e na previsão da eficácia.
Além da utilização de testes urinários como guia para decisões terapêuticas, a metodologia pode ainda ser aplicada ao monitoramento de intervenções farmacêuticas. A análise longitudinal de catecolaminas e metabólitos urinários revelou que a desipramina, um inibidor da recaptação de NE, aumentou os níveis urinários de NE e diminuiu os níveis de MHPG (Schildkraut et al., 1992). Posteriormente, foi descrito que a desipramina aumentou a excreção intacta de NE na urina e reduziu a taxa de excreção de metabólitos (Schatzberg, 1998). Como tal, dados limitados mas promissores demonstraram que a análise dos neurotransmissores urinários pode refletir alterações causadas por medicamentos psicotrópicos e monitorizar a eficácia do tratamento em pacientes deprimidos.
1.6 Neurotransmissores urinários e TDAH
A análise dos neurotransmissores urinários tem sido utilizada para avaliar a bioquímica neural em relação aos sintomas do transtorno de déficit de atenção e hiperatividade (TDAH) (Hanna et al., 1996, Kusaga et al., 2002). Foi demonstrado que pacientes com TDAH apresentam alterações na excreção urinária de β-feniletilamina (PEA) e catecolaminas (Hanna et al., 1996, Kusaga et al., 2002). É importante ressaltar que a PEA é um neurotransmissor monoamina que possui funções semelhantes às da anfetamina que podem alterar o humor e a atenção (Berry, 2004). Níveis reduzidos de PEA têm sido associados a sintomas de desatenção (Berry, 2004). Os níveis urinários de PEA foram significativamente mais baixos em pacientes com TDAH em comparação com controles normais, indicando que distúrbios na PEA contribuem para a diminuição da atenção e do foco (Baker et al., 1991, Kusaga et al., 2002). Além disso, níveis mais baixos de E urinário e 3,4-dihidroxifenilglicol (DOPEG), um metabólito de NE, foram encontrados em uma população de adolescentes do sexo masculino com diagnóstico de TDAH, sugerindo metabolismo anormal de NE e E no TDAH (Hanna et al., 1996). Maior excreção urinária de E também foi observada em indivíduos com TDAH e ansiedade comórbidos (Pliszka et al., 1994). Tomados em conjunto, esses achados sugerem que a função simpatoadrenomedular pode estar alterada em indivíduos com TDAH (Anderson et al., 2000).
Um modo comum de intervenção para o TDAH é o uso de medicamentos estimulantes (Cormier, 2008). A pesquisa relatou mudanças nos níveis de neurotransmissores urinários em conjunto com o uso de estimulantes em indivíduos com TDAH (Hermens et al., 2006). Após o tratamento com metilfenidato, um estimulante que inibe a recaptação de NE e DA, os níveis urinários de PEA aumentaram significativamente nos que responderam à medicação, enquanto os que não responderam não demonstraram uma alteração significativa (Kusaga et al., 2002). Além disso, o tratamento com metilfenidato demonstrou aumentar os níveis urinários de E (Elia et al., 1990). Curiosamente, os efeitos do metilfenidato na excreção de neurotransmissores demonstraram ser diferentes dos da dextroanfetamina, outro estimulante do SNC. A NE urinária e a normetanefrina (NMN), um metabólito da NE, foram significativamente elevadas após a administração de metilfenidato, enquanto após o tratamento com dextroanfetamina, a excreção de MHPG foi reduzida sem alterações na NE e NMN (Zametkin et al., 1985, Zametkin e Hamburger, 1988). Essas descobertas ilustraram a utilização de medições de neurotransmissores urinários para determinar os desequilíbrios bioquímicos subjacentes que existem em indivíduos com TDAH para garantir a seleção adequada do tratamento e monitorar a eficácia do tratamento.
1.7 Neurotransmissores urinários e inflamação
Historicamente, os médicos têm utilizado medidas de histamina urinária (HIST) como meio de monitorar reações anafiláticas recorrentes (Hershko et al., 2001, Tang, 2003, Yamatodani, 1990). Produtos químicos como HIST, prostaglandinas e leucotrienos são liberados por desgranulação de basófilos e mastócitos durante uma reação anafilática (Schwartz, 2004) e podem ser detectados na urina e no plasma (Hogan e Schwartz, 1997). O HIST circulante é excretado intacto pelos rins, permitindo a utilização de medidas urinárias para monitorar as flutuações no HIST plasmático com a vantagem de maior estabilidade e acessibilidade (Myers et al., 1981). Além disso, a investigação demonstrou que os níveis urinários de HIST podem ser úteis na avaliação de condições inflamatórias diferentes da anafilaxia (Asano et al., 1995, Hershko et al., 2001, Nishiwaki et al., 2000, Skoner et al., 2001). A asma, uma condição na qual as vias aéreas ficam inflamadas e contraídas, causando dificuldade em respirar, foi avaliada usando HIST urinário (Asano et al., 1995, Nishiwaki et al., 2000). Alguns estudos não mostraram alterações significativas na variação diurna do HIST urinário em pacientes asmáticos moderados a graves em comparação com controles (Asano et al., 1995). Outros estudos revelaram concentrações aumentadas de HIST urinário e de 1-metil-histamina, um metabólito da histamina, após ataques de asma (Nishiwaki et al., 2000). A diferença nos resultados pode ser devida à proximidade da coleta de urina com um ataque de asma.
A pesquisa também examinou o HIST urinário em indivíduos com cistite intersticial, uma doença da bexiga urinária caracterizada pelo aumento da frequência urinária. Os níveis urinários de HIST e de interleucina-6 urinária foram significativamente maiores em indivíduos com cistite intersticial do que nos controles (Lamale et al., 2006). A prata nanocristalina (1%) pode ser uma intervenção antiinflamatória útil para cistite intersticial, conforme evidenciado pela diminuição do HIST urinário, fator de necrose tumoral-α (TNF-α) e ativação de mastócitos após administração (Boucher et al., 2008). Além disso, em indivíduos com mastocitose sistêmica, o tratamento com terapia com interferon α-2b causou uma diminuição no HIST urinário e sérico (Hubner et al., 1997, Takasaki et al., 1998). Este conjunto de evidências sugere que as medições urinárias do HIST podem fornecer um método não invasivo de avaliação de reações anafiláticas juntamente com outras condições inflamatórias, bem como de monitoramento de tratamentos imunomoduladores (Murdoch et al., 1993).
As ações de outros neurotransmissores também foram examinadas quanto ao seu papel nos processos inflamatórios. Elenkov e Chrousos (2002) descrevem um mecanismo no qual NE e E podem modular os níveis de citocinas agindo em receptores adrenérgicos localizados em células do sistema imunológico. Em uma revisão de Elenkov et al. (2009), os autores ilustram que NE e E possuem ações imunomoduladoras por meio do ajuste fino das respostas imunes. Estas catecolaminas podem exercer efeitos pró e anti-inflamatórios dependendo da natureza dos antígenos que iniciam a resposta imune e/ou da presença de subtipos específicos de receptores localizados nas células imunes (para revisão, ver Elenkov et al., 2009). Atualmente, os estudos não examinaram a relação entre NE e E urinário e inflamação. Com base nas informações atuais que estabeleceram uma relação entre as catecolaminas e a imunomodulação, pesquisas futuras devem ser realizadas para determinar se existem alterações nas catecolaminas urinárias com processos inflamatórios.
1.8 Limitações da avaliação dos neurotransmissores urinários
Uma limitação primária da avaliação dos neurotransmissores urinários é que os neurotransmissores, em qualquer meio, não são reconhecidos como diagnósticos para qualquer doença ou condição específica, com exceção do feocromocitoma (Duncan et al., 1988, Westphal, 2005). A menos que mais pesquisas possam elucidar as capacidades diagnósticas, a tecnologia dos neurotransmissores urinários continuará sendo uma avaliação funcional. Uma segunda limitação diz respeito aos dados insuficientes sobre a origem dos neurotransmissores urinários. Os neurotransmissores são sintetizados no SNC e na maioria dos órgãos do corpo, portanto, múltiplos sistemas contribuem para o conjunto urinário total de neurotransmissores (Eisenhofer et al., 1996, Eisenhofer et al., 2004). Isto representa um desafio na interpretação dos dados do transmissor urinário. Mais estudos são necessários para elucidar a relação entre o SNC e o SNP e como a atividade dos neurotransmissores do SNC influencia o conjunto total de neurotransmissores urinários. Da mesma forma, são necessários estudos para avaliar como os fatores (isto é, medicamentos e suplementos) que alteram os níveis de neurotransmissores no SNC afetam os neurotransmissores na urina e vice-versa.
Em termos de eficácia clínica, os neurotransmissores podem atuar como biomarcadores para a seleção do tratamento e o resultado do tratamento para distúrbios psiquiátricos e inflamatórios (Wong et al., 2002). São necessárias pesquisas adicionais que se concentrem no uso da análise de neurotransmissores urinários na previsão da eficácia do tratamento com medicamentos psicotrópicos e imunomoduladores. Além disso, com o desenvolvimento de modelos de neurocircuitos (Lechin e van der Dijs, 2006), a análise dos neurotransmissores urinários pode fornecer informações adicionais sobre vias específicas do SNC que contribuem para alterações nos níveis circulantes de neurotransmissores. Portanto, as avaliações dos neurotransmissores urinários podem revelar-se uma ferramenta clínica útil para compreender melhor as anomalias periféricas que resultam de alterações neurológicas em vias cerebrais específicas.
2. Conclusão
Como as avaliações urinárias não são invasivas, com a vantagem adicional de maior estabilidade em comparação com o LCR ou o sangue, o conceito de medições de neurotransmissores como um meio objetivo de avaliar a função do sistema nervoso serve como uma opção viável para o médico que aborda questões de saúde neuropsiquiátricas. A literatura atual fornece evidências de que os neurotransmissores excretados na urina podem ter um lugar na prática clínica como biomarcadores da função do sistema nervoso. As medições de neurotransmissores urinários foram inicialmente utilizadas para diagnosticar feocromocitoma (Duncan et al., 1988), mas com pesquisas progressivas, os testes de neurotransmissores mostraram-se promissores como método para avaliar pacientes com distúrbios psiquiátricos e inflamatórios (Delahanty et al., 2005; Otte et al., 2005; Anderson et al., 2000). Em apoio à avaliação dos neurotransmissores urinários, estudos demonstraram que os neurotransmissores intactos são transportados do SNC para a periferia, através de transportadores específicos da BBB, seguidos pela filtração renal dos neurotransmissores com subsequente excreção na urina. Além disso, estudos em animais sugeriram uma relação entre neurotransmissores excretados na urina e neurotransmissores no SNC (Lynn-Bullock et al., 2004). Atualmente, existem dados limitados que examinam a associação entre o SNC e o neurotransmissor urinário em humanos. Como tal, esta lacuna científica representa uma limitação significativa na viabilidade dos testes de neurotransmissores urinários na previsão da função precisa do SNC e precisa ser abordada em investigações futuras. Por último, esta revisão demonstrou que muitos estudos revelaram associações entre neurotransmissores urinários e diversas condições clínicas, bem como associações com eficácia terapêutica. Embora a associação entre neurotransmissores encontrados no SNC e na urina seja em grande parte desconhecida, existem muitos dados clínicos que sugerem que o teste de neurotransmissores urinários é uma ferramenta poderosa para avaliar a função do sistema nervoso e, assim, permitir que os médicos monitorem e tratem várias condições clínicas.
Agradecimentos
Gostaríamos de agradecer a Chasatie Tretsven e a Diana Colton pelo desenvolvimento dos gráficos, a Paul Wynveen, ao Dr. Han Huisman e à Dra. Mikaela Nichkova pela revisão e ao Dr. Gottfried Kellermann pelo seu incentivo e apoio a este manuscrito.
Referências
Acara, M.,Rennick, B., 1973. Regulation of plasma choline by the renal tubule: bidirectional transport of choline. Am. J. Physiol. 225,1123-1128.
Amara, S.G., Kuhar, M.J., 1993. Neurotransmitter transporters: recent progress. Annu. Rev.Neurosci.16,73-93.
Anderson, G.M., Dover, M.A., Yang, B.P., Holahan, J.M., Shaywitz, S.E., Marchione, K.E., Hall, L.M., Fletcher, J.M., Shaywitz, B.A., 2000. Adrenomedullary function during cognitive testing in attention deficit/hyperactivity disorder. J.Am.Acad.Child Adolesc. Psychiatry 39, 635-643.
Arriza, J.L., Fairman, W.A., Wadiche, J.I., Murdoch, G.H., Kavanaugh, M.P., Amara, S.G., 1994. Functional comparisons of three glutamate transporter subtypes cloned from human motor cortex. J. Neurosci.14, 5559-5569.
Asano, K., Lilly, C.M., O’Donnell, W.J., Israel, E., Fischer, A.,Ran sil, B.J., Drazen, J.M., 1995. Diurnal variation of urinary leukotriene E4 and histamine excretion rates in normal subjects and patients with mild to moderate asthma. J. Allergy Clin. Immunol. 96, 643-651.
Baker, G.B., Bornstein, R.A., Rouget, A.C., Ashton , S.E., van Muyden, J. C., Coutts, R.T., 1991. Phenylethylaminergic mechanisms in attention deficit disorder. Biol. Psychiatry 29,15-22.
Ballabh, P., Braun, A., Nedergaard, M., 2004.The blood brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol. Dis.16, 1-13.
Benazzi, F., 2006. Various forms of depression. Dialogues Clin. Neurosci. 8, 151-161.
Berry, M.D., 2004. Mammalian central nervous system trace amines. Pharmacologic amphetamines, physiologic neuromodulators. J. Neuro chem. 90, 257-271.
Bloom, F.E., Kupfer, D.J., 1995.Psychopharmacology: the fourth generation of progress, pp. 407-471.
Boucher, W., Stern, J. M., Kotsinyan, V., Kempuraj, D., Papaliodis, D., Cohen, M.S., Theoharides, T.C., 2008. Intravesical nanocrystalline silver decreases experimental bladder inflammation. J. Urol. 179, 1598–1602.
Breidert, T., Spitzenberger, F., Grundemann, D., Schomig, E.,1998. Catecholamine transport by the organic cation transporter type 1 (OCT1). Br. J. Pharmacol.125, 218-224.
Busch, A.E., Karbach, U., Miska, D., Gorboulev, V., Akhoundova, A., Volk, C.,Arndt, P., Ulzheimer, J.C., Sonders, M.S., Baumann, C., Waldegger, S., Lang, F., Koepsell, H., 1998. Human neurons express the poly specific cation transporter hOCT2, which transl ocates monoamine neurotransmitters, amantadine, and memantine. Mol. Pharmacol. 54,342-352.
Busch, A.E., Quester, S., Ulzheimer, J.C., Gorboulev, V., Akhoundova, A., Waldegger, S., Lang, F., Koepsell, H., 1996. Monoamine neurotransmitter transport mediated by the polyspecific cation transporter rOCT1. FEBS Lett. 395, 153-156.
Castellanos, F.X., Elia, J., Kruesi, M.J., Gulotta, C.S., Mefford, I.N., Potter, W.Z., Ritchie, G.F., Rapoport, J.L., 1994. Cerebro spinal fluid monoamine metabolites in boys with attention deficit hyperactivity disorder. Psychiatry Res. 52, 305-316.
Chekhonin, V.P., Baklaushev, V.P., Kogan, B.M., Savchenko, E.A., Lebedev, S.V., Man’kovskaya, I.V., Filatova, T.S., Yusupova, I.U., Dmitrieva, T.B., 2000. Catecholamines and their metabolites in the brain and urine of rats with experimental Parkinson’s disease. Bull. Exp. Biol. Med. 130, 805- 809.
Chen, N.H., Reith, M.E., Quick, M.W., 2004. Synaptic uptake and beyond: the sodium and chloride dependent neurotransmitter transporter family SLC6. Pflugers Arch. 447, 519-531.
Cook, I.A., 2008. Biomarker s in psychiatry: potentials, pitfalls, and pragmatics. Prim. Psychiatry 15,54-59.
Cormier, E., 2008. Attention deficit/hyperactivity disord er: are view and update. J. Pediatr. Nurs.23, 345-357.
Dantonello, T.M., Kuster, E., Muhlbauer, B., 1998. Urinary dopamine and renal handling of L DOPA in fasted spontaneously hypertensive rats. Kidney Blood Press. Res. 21(6),438-444.
Davis, T.P., Gehrke, C.W., Gehrke Jr., C.W., Cunningham, T.D., Kuo, K.C., Gerhardt, K.O., Johnson, H.D., Williams, C.H., 1978. High performance liquid chromatographic separation and fluorescence measurement of biogenic amines in plasma, urine, and tissue. Clin. Chem. 24, 1317-1324.
Delahanty, D.L., Nugent, N.R., Christopher, N.C., Walsh, M., 2005. Initial urinary epinephrine and cortisol levels predict acute PTSD symptoms in child trauma victims. Psychoneuroendocrinology 30,121-128.
Duncan, M.W., Compton, P., Lazarus, L., Smythe, G.A., 1988. Measurement of norepinephrine and 3,4 dihydroxyphenylglycol in urine and plasma for the diagnosis of pheochromocytoma. N. Engl. J. Med. 319, 136-142.
Eisenhofer, G., Kopin, I.J., Goldstein, D.S., 2004. Catecholamine metabolism: a contemporary view with implications for physiology and medicine. Pharmacol. Rev. 56, 331-349.
Eisenhofer, G., McCarty, R., Pacak, K., Russ, H., Schomig, E., 1996. Disprocynium24, a novel inhibitor of the extraneuronal monoamine transporter, h as potent effects on the inactivation of circulating noradrenaline and adrenaline in conscious rat. Naunyn Schmiedebergs Arch.Pharmacol. 354,287-294.
Elenkov, I.J., Chrousos, G.P., 2002. Stress hormones, proinflammatory and anti inflammatory cytokines, and autoimmunity. Ann. N.Y. Acad. Sci. 966, 290-303.
Elenkov, I.J., Wilder, R.L., Chrousos, G.P., Vizi, E.S., 2009. The sympathetic nerve An integrative interface between two supersystems: the brain and the immune system. Pha rmacol. Rev. 52, 595-638.
Elia, J., Borcherding, B.G., Potter, W.Z., Mefford, I.N., Rapoport, J.L., Keysor, C.S., 1990. Stimulant drug treatment of hyperactivity: biochemical correlates. Clin. Pharmacol. Ther. 48 ,57-66.
Engel, A., von Euler, U.S., 1950. Diagnostic value of increased urinary output of pheochromocytoma. Lancet 2, 387.
Engel, K., Wang, J., 2005. Interaction of organic cations with a newly identified plasma membrane monoamine transporter. Mol. Pharmacol. 68, 1397-1407.
Fernstrom, J.D., Fernstrom, M.H., 2007. Tyrosine, phenylalanine, and catecholamine synthesis and function in the brain. J. Nutr. 137, 1539S- 1547S.
Francis, R.C., Pickerodt, P.A., Salewski, L., Boemke, W., Hohne, C., 2010. Detection of catecholamines and metanephrines by radio immunoassay in canine plasma. Vet. J.183,228-231.
Gallowitsch Puerta, M., Pavlov, V.A., 2007. Neuro immune interactions via the cholinergic anti inflammatory pathway. LifeSci. 80, 2325-2329.
Gorboulev, V., Ulzheime r, J.C., Akhoundova, A., Ulzheimer Teuber, I., Karbach, U., Quester, S., Baumann, C., Lang, F., Busch, A.E., Koepsell, H., 1997. Cloning and characterization of two human polyspecific organic cation transporters. DNA Cell Biol.16, 871-881.
Graefe, K.H., Friedgen, B., Wolfel, R., Bossle, F., Russ, H., Schomig, E., 1997. 1,1 Diisopropyl 2,4 cyanine ( a potent uptake2 blocker, inhibits the renal excretion of catecholamines. Naunyn Schmiedebergs Arch. Pharmacol. 356, 115-125.
Grossman, F., Potter, W.Z., 1999. Catecholamines in depression: a cumulative study of urinary norepinephrine and its major metabolites in unipolar and bipolar depressed patients versus healthy volunteers at the NIMH. Psychiatry Res.87, 21-27.
Grundemann, D., Babin Ebell, J., Martel, F., Ording, N., Schmidt, A., Schomig, E., 1997. Primary structure and functional expression of the apical organic cation transporter from kidney epithelial LLC PK1 cells. J.Biol.Chem. 272,10408-10413.
Grundemann, D., Koster, S., Kiefer, N., Breidert, T., Engelhardt, M., Spitzenberger, F., Obermuller, N., Schomig, E., 1998. Transport of monoamine transmitters by the organic cation transporter type 2, OCT2. J. Biol. Chem. 273, 30915-30920.
Hanna, G.L., Ornitz, E.M., Hariharan, M., 1996. Urinary catecholamine excretion and behavioral differences in ADHD and normal boys. J. Child Adolesc. Psychopharmacol. 6, 63-73.
Hardebo, J.E., Owman, C., 1980. Characterization of the in vitro uptake of monoamines into brain microvessels. Acta Physiol. Scand. 108, 223- 229.
Hawkins, R.A., O’Kane, R.L., Simpson, I.A., Vina, J.R., 2006. Structure of the blood brain barrier and its role in the transport of aminoacids. J. Nutr. 136, 218S-226S.
Hayer Zillgen, M., Bruss, M., Bonisch, H., 2002. Expression and pharmacological profile of the human organic cation transporters hOCT1, hOCT2 and hOCT3. Br.J. Pharmacol. 136,829-836.
Henderson, J.,2005. Ernest starling and ‘ an historical commentary. J. Endocrinol. 184,5-10.
Hermens, D.F., Rowe, D.L., Gordon, E., Williams, L.M., 2006. Integrative neuroscience approach to predict ADHD stimulant response. Expert. Rev. Neurother. 6, 753-763.
Hershko, A.Y., Dranitzki, Z., Ulmanski, R., Levi Schaffer, F., Naparstek, Y., 2001. Constitutive hyperhistaminaemia: a possible mechanism for recurrent anaphylaxis. Scand. J.Clin.Lab.Invest.61,449-452.
Hogan, A.D., Schwartz, L.B., 1997. Markers of mast cell degranulation. Methods 13, 43-52.
Holsboer, F., 2008. How can we realize the promise of personalized antidepressant medicines? Nat. Rev. Neurosci. 9,638-646.
Hosoya, K., Sugawara, M., Asaba, H., Terasaki, T., 1999. Blood brain barrier produces significant efflux of L aspartic acid but not D aspartic acid: in vivo evidence using the brain efflux index method. J. Neurochem. 73, 1206-1211.
Hubner, C., Wedding, U., Strater, J., Limberg, B., Stremmel, W., 1997. Clinical stable systemic mastocytosis with interferon alpha 2b therapy. J. Intern. Med. 241, 529-533.
Hughes, J.W., Watkins, L., Blumenthal, J.A., Kuhn, C., Sherwood, A., 2004. Depression and anxiety symptoms are related to increased 24 hour urinary norepinephrine excretion among healthy middle aged women. J. Psychosom. Res. 57, 353-358.
Huisman, H., Wynveen, P., Setter, P.W., 2010. Studies on the immuneresponse and preparation of antibodies against a large panel of conjugated neurotransmitters and biogenicamines: specific polyclonal antibody response and tolerance. J. Neurochem. 112,829-841.
Huszti, Z., Deli, M.A., Joo, F., 1995. Carrier mediated uptake and release of histamine by cultured rat cerebral endothelial cells. Neurosci. Lett. 184,185-188.
Joyce, P.R., Fergusson, D.M., Woollard, G., Abbott, R.M., Horwood, L.J., Upton, J., 1995. Urinary catecholamines and plasma hormones predict mood state in rapid cycling bipolar affective disorder. J. Affect. Disord. 33,233-243.
Kagedal, B., Goldstein, D.S., 1988. Catecholamines and their metabolites. J. Chromatogr. 429,177-233.
Kakee, A., Takanaga, H., Terasaki, T., Naito, M., Tsuruo, T.,Sugiyama, Y., 2001. Efflux of a suppressive neurotransmitter, GABA, across the blood brain barrier. J. Neurochem. 79,110-118.
Karbach, U., Kricke, J., Meyer Wentrup, F., Gorboulev, V., Volk, C., Loffing Cueni, D., Kaissling, B., Bachmann, S., Koepsell, H., 2000. Localization of organic cation transporters OCT 1 and OCT2 in rat kidney. Am. J. Physiol. Renal Physiol.279, F679-F687.
Kekuda, R., Prasad, P.D., Wu, X., Wang, H., Fei, Y.J., Leibach, F.H., Ganapathy, V., 1998. Cloning and functional characterization of a potential sensitive, polyspecific organic cation transporter ( most abundantly expressed in placenta. J. Biol.Chem.273,15971-15979.
Koepsell, H., Busch, A., Gorboulev, V., Arndt, P., 1998. Structure and function of renal organic cation transporters. News Physiol. Sci. 13, 11-16.
Koepsell, H., Gorboulev, V., Arndt, P., 1999. Molecular pharmacology of organic cation transporters in kidney. J. Membr. Biol. 167,103-117.
Kopp, U., Bradley, T., Hjemdahl, P., 1983. Renal venous outflow and urinary excretion of norepinephrine, epinephrine, and dopamine during graded renal nerve stimulation. Am. J. Physiol. 244,E52-E60.
Koslow, S.H., Maas, J.W., Bowden, C.L., Davis, J.M., Hanin, I., Javaid, J., 1983. CSF and urinary biogenic amines and metabolites in depression and mania. A controlled, univariate analysis. Arch. Gen. Psychiatry 4 0, 999-1010.
Koslow, S.H., Maas, J.W., Bowden, C.L., Davis, J.M., Hanin, I., Javaid, J., 1986. Tricyclic antidepressant washout effects on cerebrospinal fluid and urinary monoamine and metabolites. Arch. Gen. Psychiatry 43,1012-1013.
Kotzailias, N.,Marker, M., Jilma, B., 2004. Early effects of paroxetine on serotonin storage, plasma levels, and urinary excretion: a randomized, double blind, placebo controlled trial. J. Clin. Psychopharmacol. 24, 536-539.
Kudva, Y.C., Sawka, A.M., YoungJr., W.F., 2003. Clinical review 164: the laboratory diagnosis of adrenal pheochromocytoma: the Mayo Clinic experience. J. Clin. Endocrinol. Metab. 88, 4533–4539.
Kusaga, A., Yamashita, Y., Koeda, T., Hiratani, M., Kaneko, M., Yamada, S., Matsuishi, T., 2002. Increased urine phenylethylamine after methylphenidate treatment in children with ADHD. Ann. Neurol. 52,372-374.
Lamale, L.M., Lutgendorf, S.K., Zimmerman, M.B., Kreder, K.J., 2006. Interleukin 6, histamine, and methylhistamine as diagnostic markers for interstitial cystitis. Urology 68,702-706.
Lechin, F., van der Dijs, D.B., 2006. Central nervous system circuitry and peripheral neural sympathetic activity responsible for essential hypertension. Curr. Neurovasc. Res. 3, 307-325.
Lechin, F., van der Dijs, D.B., Lechin, M.E., 1996. Plasma neurotransmitters and functional illness. Psychother. Psychosom. 65, 293-318.
Le Niculescu, H., Kurian, S.M., Yehyawi, N., Dike, C., Patel, S.D., Edenberg, H.J., Tsuang, M.T., Salomon, D.R., Nurnberger Jr., J.I., Niculescu, A.B., 2008. Identifying blood biomarkers for mood disorders using convergent functional genomics. Mol. Psychiatry 14, 156-174.
Lepschy, M., Rettenbacher, S., Touma, C., Palme, R.G., 2008. Excretion of catecholamines in rats, mice, and chicken. J. Comp. Physiol. 178, 629- 636.
Lynn Bullock, C.P., Welshhans, K., Pallas, S.L., Katz, P.S., 2004. The effect of oral 5 HTP administration on 5 HTP and 5 HT immunoreactivity in monoaminergic brain regions of rats. J. Chem. Neuroanat. 27, 129-138.
Maas, J.W., Koslow, S.H., Davis, J., Katz, M., Frazer, A., Bowden, C.L., Berman, N., Gibbons, R., Stokes, P., Landis, D.H., 1987. Catecholamine metabolism and disposition in healthy and depressed subjects . Arch. Gen. Psychiatry 44, 337-344.
Maas, J.W., Landis, D.H., 1965. A technique for assaying the kinetics of norepinephrine metabolism in the central nervous system in vivo. Psychosom. Med. 28, 247-256.
Manyam, B.V., Hare, T.A., 1983. Cerebrospinal fluid GABA measurements: basic and clinical considerations. Clin. Neuropharmacol. 6, 25-36.
Matsuda, F., Hayashi, T., Naruse, H., 1991. A study on the origins of urinary serotonin and tryptamine. Tokai J. Exp. Clin. Med. 16, 245-252.
Mayer, E.A., Tillisch, K., Bradesi, S., 2006. Review article: modulation of the brain gut axis as a therapeutic approach in gastrointestinal disease. Aliment. Pharmacol. Ther. 24, 919-933.
Moleman, P., Tulen, J.H., Blankestijn, P.J., Man in’t Veld, A.J., Boomsma, F., 1992. Urinary excretion of catecholamines and their metabolites in relation to circulating catecholamines. Six hour infusion of epinephrine and norepinephrine in healthy volunteers. Arch. Gen. Psychiatry 49, 568- 572.
Mooney, J.J., Cole, J.O., Schatzberg, A.F., Gerson, B., Schildkraut, J.J., 1985. Pre treatment urinary MHPG levels as predictors of antidepressant responses to alprazolam. Am. J. Psychiatry 142, 366-367.
Mooney, J.J., Samson, J.A., Hennen, J., Pappalardo, K., McHale, N., Alpert, J., Koutsos, M., Schildkraut, J.J., 2008. Enhanced norepinephrine output during long term desipramine treatment: a possible role for the extraneuronal monoamine transporter (SLC22A3). J. Psychiatr. Res. 42, 605-611.
Mooney, J.J., Schatzberg, A.F., Cole, J.O., Kizuka, P.P., Salomon, M., Lerbinger, J., Pappalardo, K.M., Gerson, B., Schildkraut, J.J., 1988. Rapid antidepressant response to alprazolamin depressed patients with high catecholamine output and heterologous desensitization of platelet adenylate cyclase. Biol. Psychiatry 23, 543-559.
Mooney, J.J., Schatzberg, A.F., Cole, J.O., Samson, J.A., Waternaux, C., Gerson, B., Pappalardo, K.M., Schildkraut, J.J., 1991. Urinary 3 methoxy 4 hydroxyphenylglycol and the de pression type score as predictors of differential responses to antidepressants. J. Clin. Psychopharmacol. 11, 339- 343.
Moyer, T.P., Jiang, N.S., Tyce, G.M., Sheps, S.G., 1979. Analysis for urinary catecholamines by liquid chromatography with amperometric detection: methodology and clinical interpretation of results. Clin. Chem. 25, 256-263.
Murdoch, R.D., Youlten, L.J., Williams, A.J., Howland, K., 1993. Plasma concentrations and urinary excretion of histamine after inhalation and subcutaneous injection of histamine. Br. J. Clin. Pharmacol. 35, 171-177.
Myers, G., Donlon, M., Kaliner, M., 1981. Measurement of urinary histamine: development of methodology and normal values. J. Allergy Clin. Immunol. 67, 305-311.
Nakatani, Y., Sato-Suzuki, I., Tsujino, N., Nakasato, A., Seki, Y., Fumoto, M., Arita,H., 2008. Augmented brain 5 HT crosses the blood brain barrier through the 5 HT transporter in rat. Eur. J. Neurosci. 27, 2466-2472.
Nemeroff, C.B., 2007. The burden of severe depression: are view of diagnostic challenges and treatment alternatives. J. Psychiatr. Res. 41, 189- 206.
Nigrovic, L.E., McQueen, A.A., Neuman, M.I., 2007. Lumbar puncture success rate is not influenced by family member presence. Pediatrics 120, e777–e782.
Nishiwaki, F., Kuroda, K., Inoue, Y., Endo, G., 2000. Determination of histamine, 1 methylhistamine, and N methylhistamine by capillary electrophoresis with micelles. Biomed. Chromatogr. 14,184-187.
Noshiro, T., Saigusa, T., Way, D., Dorward, P. K., McGrath, B.P., 1991. Norepinephrine spill over faithfully reflects renal sympathetic nerve activity in conscious rabbits. Am. J. Physiol. 261, F44-F50.
Ohtsuki, S., 2004. New aspects of the blood brain barrier transporters; its physiological roles in the central nervous system. Biol. Pharm. Bull. 27, 1489-1496.
Okumura, T., Nakajima, Y., Matsuoka, M., Takamatsu, T.,1997. Study of salivary catecholamines using fully automated column switching high performance liquid chromatography. J. Chromatogr. BBiomed. Sci. Appl. 694, 305-316.
Otte, C., Neylan, T.C., Pipkin, S.S., Browner, W.S., Whooley, M.A., 2005. Depressive symptoms and 24 hour urinary norepinephrine excretion levels in patients with coronary disease: findings from the Heart and Soul Study. Am. J. Psychiatry 162, 2139-2145.
Panholzer, T.J., Beyer, J., Lichtwald, K., 1999. Coupled column liquid chromatographic analysis of catecholamines, serotonin, and metabolites in human urine. Clin. Chem. 45, 262-268.
Pardridge, W.M.,1999. Blood brain barrier biology and methodology. J. Neurovirol. 5, 556-569.
Pliszka, S.R., Maas, J.W., Javors, M.A., Rogeness, G.A., Baker, J.,1994. Urinary catecholamines in attention deficit hyperactivity disorder with and without comorbid anxiety. J. Am. Acad. Child Adolesc. Psychiatry 33, 1165-1173.
Rosano, T.G., Swift, T.A., Hayes, L.W., 1991. Advances in catecholamine and metabolite measurements for diagnosis of pheochromocytoma. Clin. Chem. 37, 1854-1867.
Roy, A., Linnoila, M., Karoum, F., Pickar,D.,1986a. Relative activity of metabolic pathways for norepinephrine in endogenous depression. Acta Psychiatr. Scand. 73, 624-628.
Roy, A.,Pickar,D.,De,J.J.,Karoum,F.,Linnoila,M.,1988. Norepinephrine and its metabolites in cerebrospinal fluid, plasma, and urine. Relationship to hypothalamic pituitary adrenal axis function in depression. Arch. Gen. Psychiatry 45, 849-857.
Roy, A.,Pickar,D.,Douillet,P.,Karoum,F.,Linnoila,M.,1986b. Urinary monoamines and monoamine metaboli tes in subtypes of unipolar depressive disorder and normal controls. Psychol. Med. 16, 541-546.
Roy, A.,Pollack,S.,1994. Are cerebrospinal fluid or urinary monoamine metabolite measures stronger correlates of suicidal behavior in depression? Neuropsychobiology 29, 164-167.
Rubin, L.L.,Staddon,J.M.,1999. The cell biology of the blood brain barrier. Annu. Rev. Neurosci.22,11-28.
Schatzberg, A.F.,1998. Noradrenergic versus serotonergic antidepressants: predictors of treatment response. J. Clin. Psychiatry 59 (Suppl. 15-18.
Schildkraut, J.J., Orsulak, P.J., Schatzberg, A.F., Gudeman, J.E., Cole, J.O., Rohde, W.A., LaBrie, R.A., 1978. Toward a biochemical classification of depressive disorders. I. Differences in urinary excretion of MHPG and other catecholamine metabolites in clinically defined subtypes of depressions. Arch. Gen. Psychiatry 35, 1427-1433.
Schildkraut, J.J.,Schatzberg,A.F.,Samson,J.A.,Rosenbaum,A.,Bowden,C.L.,1992. Norepinephrine output and metabolism in depressed patients during antidepressant treatments. Clin. Neuropharmacol. 15 (Suppl. 323A-324A.
Schwartz, L.B.,2004. Effector cells of anaphylax is: mast cells and basophils. Novartis. Found. Symp.257, 65-74.
Schwarz, E.,Bahn,S.,2008. The utility of biomarker discovery approaches for the detection of disease mechanisms in psychiatric disorders. Br. J. Pharmacol. 153 (Suppl. S133-S136.
Seegal, R.F.,Brosch,K.O.,Bush,B.,1986. High performance liquid chromatography of biogenic amines and metabolites in brain, cerebrospinal fluid, urine, and plasma. J. Chromatogr.377,131-144.
Skoner, D.P.,Gentile,D.A.,Fireman,P.,Cordoro,K.,Doyle,W.J.,2001. Urinary histamine metabolite elevations during experimental in fl uenza infection. Ann. Allergy AsthmaImmunol.87,303-306.
Swann, A.C., Koslow, S.H., Katz, M.M., Maas, J.W., Javaid, J., Secunda, S.K., Robins, E., 1987. Lithium carbonate treatment of mania. Cerebrospinal fluid and urinary monoamine metabolites and treatment outcome. Arch. Gen. Psychiatry 44, 345-354.
Szabo, A., Billett, E., Turner, J., 2001. Phenylethylamine, a possible link to the antidepressant effects of exercise? Br. J. Sports Med. 35, 342-343.
Takanaga, H.,Ohtsuki,S.,Hosoya,K.,Terasaki,T.,2001. GAT2/BGT 1 as a system responsible for the transport of gamma aminobutyric acid at the mouse blood brain barrier. J. Cereb. Blood Flow Metab. 21, 1232-1239.
Takasaki, Y., Tsukasaki, K., Jubashi, T., Tomonaga, M., Kamihira, S., Makiyama, K., 1998. Systemic mastocytosis with extensive polypoid lesions in the intestines; successful treatment with interferon alpha. Intern. Med. 37, 484-488.
Tamai, I.,Tsuji,A.,2000. Transporter mediated permeation of drugs across the blood brain barrier. J. Pharm. Sci. 89, 1371-1388.
Tang, A.W.,2003. A practical guide to anaphylaxis. Am. Fam. Physician 68, 1325-1332.
von Euler,U.S.,Hellner,S.,1951. Excretion of noradrenaline, adrenaline, and hydroxytyramine in urine. Acta Physiol. Scand. 22, 160-167.
von Euler,U.S.,Hellner Bjorkman,S.,Orwen,I.,1955. Diurnal variations in the excretion of free and conjugated noradrenaline and adrenaline in urine from healthy subjects. Acta Physiol. Scand. Suppl.33, 10-16.
von Euler,U.S.,Luft,R.,1951. Noradrenaline output in urine after infusion in man. Br. J. Pharmacol. Chemother. 6, 286-288.
Wa, T.C.,Burns,N.J.,Williams,B.C. C.,Freestone,S.,Lee,M.R., Blood and urine 5 hydroxytryptophan and 5 hydroxytryptamine levels after administration of two 5 hydroxytryptamine precursors in normal man. Br. J. Clin. Pharmacol. 39, 327-329.
Wakayama, K.,Ohtsuki,S.,Takanaga,H.,Hosoya,K.,Terasaki,T.,2002. Localization of norepinephrine and serotonin transporter in mouse brain capillary endothelial cells. Neurosci.Res.44,173-180.
Westermann, J.,Hubl,W.,Kaiser,N.,Salewski,L.,2002. Simple, rapid, and sensiti ve determination of epinephrine and norepinephrine in urine and plasma by non competitive enzyme immunoassay, compared with HPLC method. Clin. Lab. 48, 61-71.
Westphal, S.A.,2005. Diagnosis of a pheochromocytoma. Am. J. Med. Sci. 329, 18-21.
Wong, D.F.,Potter,W.Z.,Brasic,J.R.,2002. Proof of concept: functional models for drug development in humans. In: Davis, K.L., Charney, D., Coyle, J.T., Nemeroff, C. ( Neuropsychopharmacology: Fifth Generation of progress. Lippincott Williams &Wilkins,Philadelphia,pp.457-473.
Wood, J.H.,1980. Neurochemical analysis of cerebrospinal fluid. Neurology 30, 645-651.
Wu, X., Huang, W., Ganapathy, M.E., Wang, H., Kekuda, R., Conway, S.J., Leibach, F.H., Ganapathy, V., 2000. Structure, function, and r egional distribution of the organic cation transporter OCT3 in the kidney. Am. J. Physiol. Renal Physiol. 279, F449-F458.
Wu, X., Kekuda, R., Huang, W., Fei, Y.J., Leibach, F.H., Chen, J., Conway, S.J., Ganapathy, V., 1998. Identity of the organic cation transporter OCT3 as the extraneuronal monoamine transporter ( and evidence for the expression of the transporter in the brain. J. Biol. Chem. 273, 32776-32786.
Wurtman, R.J.,1987. Nutrients affecting brain composition and behavior. Integr. Psychiatry 5,226-238.
Wurtman, 1988. Effects of dietary amino acids, carbohydrates, and choline on neurotransmitter synthesis. Mt. Sinai J. Med. 55, 75–86.
Yabuuchi, H., Tamai, I., Nezu, J., Sakamoto, K., Oku, A., Shimane, M., Sai, Y., Tsuji, A., 1999. Novel membrane transporter OCTN1 mediates multispecific, bidirectional, and pH dependent transport of organic cations. J. Pharmacol. Exp. Ther. 289, 768-773.
Yamatodani, A.,1990. [Plasma and urinary histamine assay and the clinical significance]. Nippon Rinsho 48(Suppl.), 171-174.
Zametkin, A.J., Hamburger, S.D., 1988. The effect of methylphenidate on urinary catecholamine excretion in hyperactivity: a partial replication. Biol. Psychiatry 23, 350-356.
Zametkin, A.J., Karoum, F., Linnoila, M., Rapoport, J.L., Brown, G.L., Chuang, L.W., Wyatt, R.J., 1985. Stimulants, urinary catecholamines, and indoleamines in hyperactivity. A comparison of methylphenidate and dextroamphetamine. Arch. Gen. Psychiatry 42,251-255.
Zarate, Saucedo, R., 2005. On the centennial of hormones. A tribute to Ernest H. Starling and William M. Bayliss. Gac. Med. Mex. 141, 437-439.
Conheça Neurostress®










